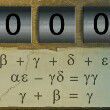求解答此化学问题
求解答此化学问题在有盐桥的铜锌原电池中,电极怎么与电解质溶液反应?为什么明明是分开的电解质溶液,怎么会发生反应呢?锌杯里是硫酸锌,铜杯里是硫酸铜,电极材料和电解质正离子是...
求解答此化学问题在有盐桥的铜锌原电池中,电极怎么与电解质溶液反应?为什么明明是分开的电解质溶液,怎么会发生反应呢?
锌杯里是硫酸锌,铜杯里是硫酸铜,电极材料和电解质正离子是同一物质,那么如何进行反应?锌单质怎样才能和铜离子反应? 展开
锌杯里是硫酸锌,铜杯里是硫酸铜,电极材料和电解质正离子是同一物质,那么如何进行反应?锌单质怎样才能和铜离子反应? 展开
展开全部
简单说,Zn比Cu金属性强,更有失去电子的趋势,Zn与Cu相连,电子有向Cu一端移动的趋势,而CuSO4中Cu2+的氧化性大于Zn2+,有得到电子的趋势,盐桥就等于是导线,这样形成回路,电子带负电,向Cu一端进发,在哪里遇到Cu2+,发生Cu2++2e-=Cu2+
推荐律师服务:
若未解决您的问题,请您详细描述您的问题,通过百度律临进行免费专业咨询