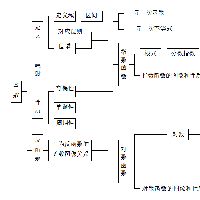
钪原子最外层电子数和次外层电子数。
钪原子的电子排布为:1s22s22p63s23p63d14s2根据这个图可以理解为:+212892求解释、+202882由这个钙可以看出是先把最外层填两个后才填次外层,这...
钪原子的电子排布为:1s2 2s2 2p6 3s2 3p6 3d1 4s2
根据这个图可以理解为:+21 2 8 9 2
求解释、
+20 2 8 8 2
由这个钙可以看出是先把最外层填两个后才填次外层,这个是为什么 展开
根据这个图可以理解为:+21 2 8 9 2
求解释、
+20 2 8 8 2
由这个钙可以看出是先把最外层填两个后才填次外层,这个是为什么 展开
3个回答
 创远信科
创远信科
2024-07-24 广告
作为上海创远仪器技术股份有限公司的团队成员,我们积累了广泛的介电常数数据。这些数据覆盖了从常见物质如空气、水、塑料到专业材料如聚苯乙烯、环乙醇等的介电常数。通过精心整理和分析,我们汇编了介电常数表合集,为客户提供了宝贵的参考信息。这些数据不...
点击进入详情页
本回答由创远信科提供
展开全部
这其中有能级交错现象,根据能量最低原理,电子在进入核外各亚层时,总是尽先占领能量最低轨道。
能级排布顺序:1s 2s2p 3s3p 4s 3d 4p 5s 4d 5p 6s …… 即3d亚层能量高于4s 所以电子首先进入4s 形成4s2 然后再进入3d ,所以出现Sc : 1s2 2s2 2p6 3s2 3p6 3d1 4s2 这种排布.
除了21号Sc以外,39号Y 钇也是如,其价电子构型为:4d1 5s2
能级排布顺序:1s 2s2p 3s3p 4s 3d 4p 5s 4d 5p 6s …… 即3d亚层能量高于4s 所以电子首先进入4s 形成4s2 然后再进入3d ,所以出现Sc : 1s2 2s2 2p6 3s2 3p6 3d1 4s2 这种排布.
除了21号Sc以外,39号Y 钇也是如,其价电子构型为:4d1 5s2
已赞过
已踩过<
评论
收起
你对这个回答的评价是?
展开全部
对呀
次外层不超过18即可
次外层不超过18即可
追问
+20 2 8 8 2
由这个钙可以看出是先把最外层填两个后才填次外层,这个是为什么
追答
4s能量低于3d,所以先填充4s,后填充3d。(电子最先填充能量最低的轨道)
已赞过
已踩过<
评论
收起
你对这个回答的评价是?
更多回答(1)
推荐律师服务:
若未解决您的问题,请您详细描述您的问题,通过百度律临进行免费专业咨询