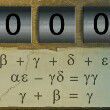电离大于水解一定显酸性么
3个回答
2017-01-10
展开全部
不一定。
1、酸的溶液只有电离,没有水解的说法,也就不存在比较谁大的问题
2、正盐完全电离,然后水解,强酸弱碱盐水解显酸性
强碱弱酸盐水解显碱性
3、只有酸式盐才需要比较电离与水解的程度
如:NaHCO3、NaHSO3
1、酸的溶液只有电离,没有水解的说法,也就不存在比较谁大的问题
2、正盐完全电离,然后水解,强酸弱碱盐水解显酸性
强碱弱酸盐水解显碱性
3、只有酸式盐才需要比较电离与水解的程度
如:NaHCO3、NaHSO3
本回答被网友采纳
已赞过
已踩过<
评论
收起
你对这个回答的评价是?
展开全部
不是
电离有电常离数,水解有水解常数,谁大就显谁的性
电离度是指一种盐溶液的水溶液中,水将它们电离成阳离子和阴离子的能力。水解程度是指这种盐溶液中弱离子与水结合,形成相应的弱酸或者弱减的能力,或者对于双水解的盐溶液的水溶液中,形成弱酸的强弱和形成弱减的能力强弱。对于强酸和强碱,电离度越大对应的酸碱性就越强,而它们的水解程度就越弱。对于一些易溶性的盐类来说,电离度越大对应的电离出的离子越多,而它们的水解程度就越弱。一般,电离度大的,它们的水解程度就越弱,相反,电离度小的,水解程度就越大。一般,在比较有酸式酸根离子的酸或盐的溶液中的离子浓度大小的时候就要注意,它们的电离程度和水解程度。
影响水解平衡进行程度最主要因素是盐本身的性质。 ①组成盐的酸根对应的酸越弱,水解程度越大,碱性就越强,PH越大; ②组成盐的阳离子对应的碱越弱,水解程度越大,酸性越强,PH越小; 外界条件对平衡移动也有影响,移动方向应符合 勒夏特列原理
电离有电常离数,水解有水解常数,谁大就显谁的性
电离度是指一种盐溶液的水溶液中,水将它们电离成阳离子和阴离子的能力。水解程度是指这种盐溶液中弱离子与水结合,形成相应的弱酸或者弱减的能力,或者对于双水解的盐溶液的水溶液中,形成弱酸的强弱和形成弱减的能力强弱。对于强酸和强碱,电离度越大对应的酸碱性就越强,而它们的水解程度就越弱。对于一些易溶性的盐类来说,电离度越大对应的电离出的离子越多,而它们的水解程度就越弱。一般,电离度大的,它们的水解程度就越弱,相反,电离度小的,水解程度就越大。一般,在比较有酸式酸根离子的酸或盐的溶液中的离子浓度大小的时候就要注意,它们的电离程度和水解程度。
影响水解平衡进行程度最主要因素是盐本身的性质。 ①组成盐的酸根对应的酸越弱,水解程度越大,碱性就越强,PH越大; ②组成盐的阳离子对应的碱越弱,水解程度越大,酸性越强,PH越小; 外界条件对平衡移动也有影响,移动方向应符合 勒夏特列原理
已赞过
已踩过<
评论
收起
你对这个回答的评价是?
更多回答(1)
推荐律师服务:
若未解决您的问题,请您详细描述您的问题,通过百度律临进行免费专业咨询