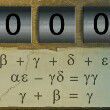2个回答
2016-10-28 · 知道合伙人教育行家
关注
![]()

展开全部
任何原子的s轨道都是球形对称的。
原子的s轨道如图:
原子轨道(Atomic orbital)是单电子薛定谔方程的合理解ψ(x,y,z)。若用球坐标来描述这组解,即ψ(r,θ,φ)=R(r)·Y(θ,φ),这里R(r)是与径向分布有关的函数,称为径向分布函数,用图形描述就是原子轨道的径向分布函数;Y(θ,φ)是与角度分布有关的函数,用图形描述就是角度分布函数。
s轨道是一种原子轨道,其角量子数为0,磁量子数也为0,且每个壳层里只有一个s轨道。
s轨道是最稳定的轨道,s轨道是围绕原子核旋转的电子轨道中最靠近原子核的一层轨道,包含两个电子,具有最低的能量,其电子出现密度的形状是球状对称的,换句话说,s轨道是一个球形的轨道。
推荐律师服务:
若未解决您的问题,请您详细描述您的问题,通过百度律临进行免费专业咨询