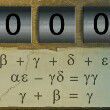为什么在锌与稀硫酸反应时加入硫酸铜溶液超过一定量时生成氢气速率
展开全部
1、为了加快反应速率,可以滴加少量硫酸铜
2、因为Zn+CuSO4=ZnSO4+Cu,生成的少量铜与锌构成原电池,大大加快了反应速率
3、便也不能使用过多的硫酸铜溶液
4、首先硫酸铜溶液消耗锌,然后生成的铜过多,会覆盖在锌表面,阻止其与酸继续反应
2、因为Zn+CuSO4=ZnSO4+Cu,生成的少量铜与锌构成原电池,大大加快了反应速率
3、便也不能使用过多的硫酸铜溶液
4、首先硫酸铜溶液消耗锌,然后生成的铜过多,会覆盖在锌表面,阻止其与酸继续反应
 11
11
2024-08-28 广告
Zn+(浓)2H2SO4=ZnS04+SO2↑+2H2O 浓硫酸有强氧化性,他与活泼金属反应不会生成氢气,因为氢气为还原性气体,不会与浓硫酸共存。反应生成的气体是二氧化硫。但随着反应进行,硫酸被消耗,其浓度变小,逐渐变成稀硫酸,又会生成氢气...
点击进入详情页
本回答由11提供
推荐律师服务:
若未解决您的问题,请您详细描述您的问题,通过百度律临进行免费专业咨询